Die high-pressure-liquid-chromatography (HPLC, Hochdruckflüssigchromatographie) oder auch high-performance-liquid-chromatography (Hochleistungschromatographie) ist ein effizientes und robustes Verfahren, das im Bereich der Arzneimittelanalytik zur Bestimmung von Gehalt, Reinheit oder Wirkstofffreisetzung eines Fertigprodukts oder Rohstoffes genutzt wird. Doch jeder Analytiker wird Situationen kennen, in denen die Chromatogramme nicht das erwartete Bild zeigen oder die HPLC-Anlage nicht wie gewohnt arbeitet. Ein Fehler ist aufgetreten.
Durch die Qualifizierung und regelmäßige Kalibrierung der Anlagenteile wie Detektor, Pumpe, Säulenofen und Probengeber ist bekannt und wird regelmäßig überprüft welche Leistung die HPLC erbringen kann. Und welche sie als vielgenutztes Arbeitstier bei guter Pflege und Wartung auch regelmäßig und über einen langen Zeitraum erbringen wird. Auch die Validierung von Methoden und die bei jeder Analytik durchgeführten Systemeignungstests wie Bestimmung der Injektionspräzision, Überprüfung der Bestimmungsgrenze, etc. tragen dazu bei, das Vertrauen des Analytikers in seine Analysenergebnisse zu stärken. Doch wenn einmal Fehler auftreten, ist die Ermittlung der Ursache und die Behebung des Fehlers häufig eine langwierige Sache, die den straffen Zeitplan schon mal durcheinander bringen kann.
Tabelle 1: Fehlerquellen und ihre Auswirkungen
| Fehlerquellen | Auswirkung | |
|---|---|---|
|
Probenahme |
|
|
| Probenaufbereitung |
|
|
| Autosampler / Injektion |
|
|
| Fließmittel |
|
|
| Pumpe |
|
|
| Säule |
|
|
| Säulenofen |
|
|
| Detektor |
|
|
| Integrationsparameter |
|
|
Minimierung von Fehlern
Deswegen ist das A und O eine Minimierung der Fehlermöglichkeiten im Vorfeld, wie z.B. durch regelmäßiges und richtiges Spülen der HPLC-Säulen, der Pflege und Wartung der HPLC-Anlage selbst, sowie die Kalibrierung der Geräte in regelmäßigen Intervallen. Aber natürlich auch durch den Einsatz von geschultem und gut ausgebildetem Personal, das versteht welchen Weg die Probe nach der Aufarbeitung von der Injektion bis zur Detektion nimmt und welche Einflussfaktoren es auf die Peakfläche gibt, und dementsprechend vorausschauend agiert. (vgl. Abbildung 1)
Fehlerursachenanalyse
Beim Auftritt eines Fehlers besteht die erste Hürde darin zur Erkennen, das ein Problem besteht (vgl. Abbildung 2). Eine unzureichende Symmetrie des Peaks oder ein schlechtes Signal-zu-Rausch-Verhältnis, die eine korrekte Integration womöglich unmöglich machen, oder Retentionszeitschwankungen, die dazu führen das Verunreinigungen falsch zugordnet werden, fallen nur dem geschulten Analytiker ins Auge. Hilfreich ist immer ein Vergleich der aktuellen Analytik mit alten Chromatogrammen und Ergebnissen. Der zweite Schritt besteht darin zu analysieren, worin die Ursache des Fehlers liegt (z.B. Temperaturschwankungen bei Retentionszeitschwankungen) und diese zu korrigieren. Dieser Eingriff ins System kann entweder zu dem gewünschten Erfolg führen oder man beginnt wieder von vorne und stellt eine neue Hypothese für die Ursache auf.
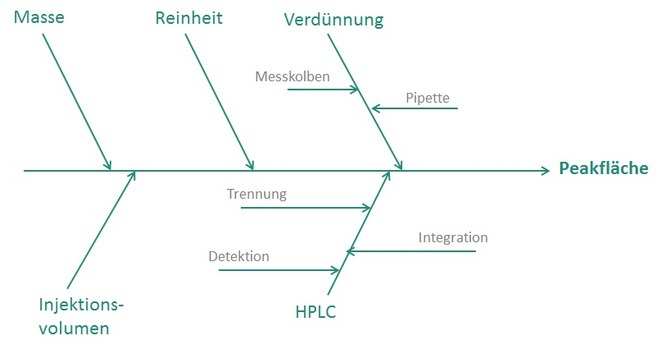
Abbildung 1: Ishikawa-Diagramm
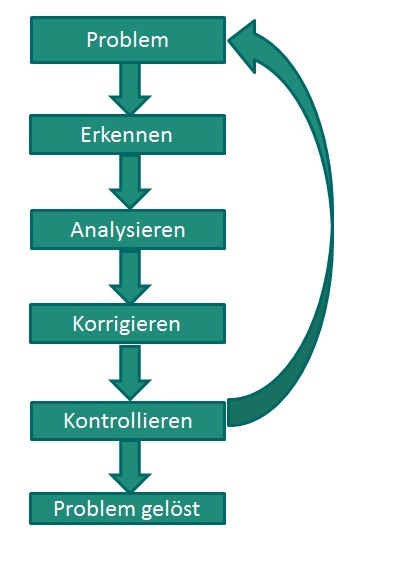
Abbildung 2: Fehlerursachenanalyse

Abbildung 3: kaputte Säulenköpfe und resultierende Peaks